
소주는 어디서 와서 어디로 가는가?
소주는 크게 두 가지 종류로 분류되는데요. 바로 희석식과 증류식 소주입니다. 아마 고등학생 독자분들께는 녹색병과 투명한 병에 들어있는 소주라고 말씀드리는 것이 더 쉬울지도 모르겠습니다. 희석식 소주 생산 공정에서는 카사바나 감자 같은 값싼 녹말 원료를 발효하여 에탄올을 만들어낸 후, 이를 연속 증류하여 ‘주정’이라 불리는 고농도의 에탄올(약 95%)을 만들어냅니다. 그 다음 주정을 물로 희석하여 도수1 를 17~25%까지 내리고, 각종 감미료2 를 넣어주면 희석식 소주가 완성됩니다.
증류식 소주는 그 방식이 약간 다릅니다. 주로 쌀을 원료로 하여 발효를 하며, 마찬가지로 증류 과정을 거치지만 고농도의 주정을 만들어내지는 않습니다. 그 대신에 17~25%의 농도에 이를 때까지 증류하여 곧바로 상품을 완성하는 것이지요. 희석식과 증류식 두 방식 모두 생산 공정에 증류가 포함되지만, 후자의 경우 주정을 물에 희석하는 과정이 없어 앞의 방식과 구별하기 위해 증류식 소주라는 표현을 사용합니다.
1 알코올 혼합물에 대한 알코올의 부피 비율
2 단맛을 내는 물질 사카린, 수크랄로스, 스테비오사이드 등이 포함된다. 자세한 내용은 공대상상 36호 기획기사 “감미료의 모든 것” 참조
효모야 힘내! 생물반응기
증류 공정과 소주는 떼려야 뗄 수 없는 관계입니다. 이는 생물반응기의 한계 농도와 관련이 있습니다. 소주 생산 공정으로 다시 돌아와 볼까요? 두 방식 모두 처음에는 녹말로부터 에탄올을 만들어내는 과정이 있다는 것을 발견할 수 있습니다. 해당 공정은 주로 효모를 이용하여 진행되는데요. 이렇게 생물을 이용해 화학반응을 수행하는 반응기를 생물반응기라고 부릅니다. 생물반응기는 여러 단계가 필요한 화학반응을 하나의 반응기 내에서 경제적으로 수행할 수 있다는 장점 때문에 최근 여러 산업체에서 적극적으로 활용되고 있습니다. 그러나 치명적인 단점 역시 존재하는데요. 바로 생물을 사용하기 때문에 변수가 많고 크기에 제약이 있다는 점입니다.
소주 생산 공정에서 바로 이러한 요인이 발목을 붙잡습니다. 발효균(효모)이 생성하는 에탄올이 일정 농도를 넘어가면 오히려 에탄올이 발효균의 생장을 막는다는 것입니다. 그래서 생물반응기를 통한 에탄올의 생성은 에탄올 농도가 높아질수록 속도가 빠르게 감소하는 특징이 있는데요. 발효균이 원하는 농도의 에탄올 용액을 만들어줄 때가지 마냥 기다릴 수만은 없기 때문에, 공학자들은 낮은 농도의 생물반응기 생산물을 증류하여 그 농도를 높이게 됩니다.
들었다 놨다, 들었다 놨다 해! 증류와 연속 증류
아마 고등학교 화학 과정을 통해 증류라는 말 자체는 익숙하실 텐데요. 한 번 더 복습하자면, 분별 증류란 끓는점 차이가 나는 두 액체 물질을 분리하기 위해 끓는점이 낮은 물질을 끓여서 분리 해내는 방식입니다. 그렇다면 연속 증류는 무엇일까요? 그 이름에서도 알 수 있듯, 이러한 분별 증류를 여러 번 반복하는 것을 의미합니다. 끓는점이 서로 다르다면 한 번만 증류를 해도 충분할 것 같은데, 도대체 왜 연속 증류를 하는 것일까요?
이를 이해하기 위해서는 그림 2의 증기압 그래프를 이해해야 합니다. 아래 그림에서 y축은 온도를 의미하고, 파란색 선은 증기 조성선, 녹색 선은 용액 조성선을 의미합니다. 증기압 그래프를 보는 방법을 빠르게 알아볼까요? 먼저 에탄올과 물이 2:8의 몰수비로 88°C에 존재(그림 2의 빨간 점)한다고 가정해봅시다. 온도가 에탄올의 끓는점인 78°C보다 높으므로, 에탄올의 일부가 기화될 것으로 예상할 수 있습니다. 이때 에탄올이 얼마나 기화되어 각각 기체와 액체의 조성이 어떻게 되는지를 알려주는 것이 바로 그림 2의 증기압 그래프입니다.
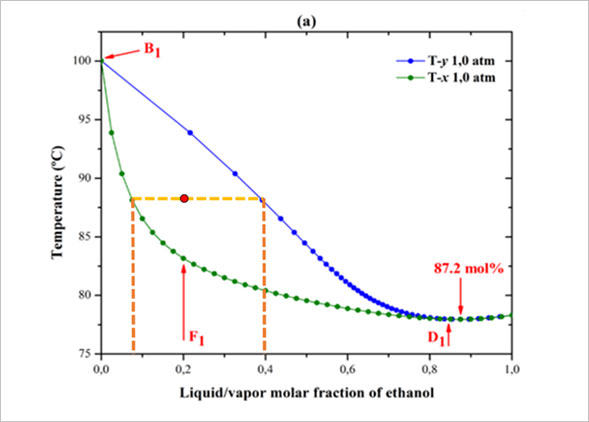
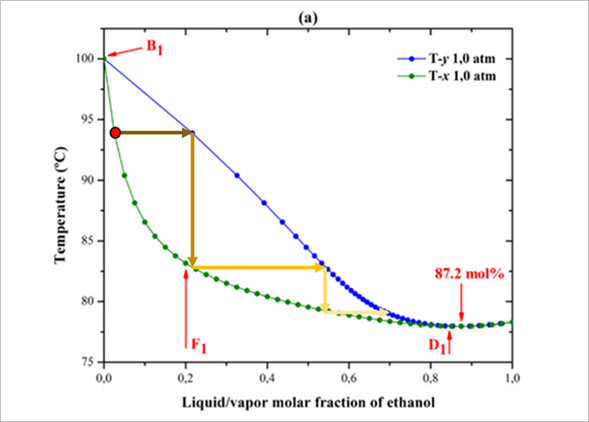
그렇다면 감압 증류는 무엇일까요? 감압 증류란, 증류 과정을 대기압보다 낮은 압력에서 수행하는 것을 의미합니다. 압력을 낮추게 되면 물질의 끓는점이 낮아지게 되는데요. 이는 그림 2의 그래프의 녹색 선과, 파란색 선을 y축 방향으로 내리는 것과 같은 효과를 줍니다. 따라서 감압 증류를 하면 상압3 증류에 비해, 똑같은 기체/액체 조성을 얻기 위해서 필요한 온도가 낮아지는 것이지요. 증류기가 작동하는 온도가 낮을수록 소주의 향을 구성하는 성분들의 보존이 쉽기 때문에 일반적으로 감압 증류를 하면 소주의 향이 더 풍부해진다고 알려져 있습니다.

실제 연속 증류장치는 어떻게 생겼을까?
소주를 만들기 위해서 연속 증류 과정이 꼭 필요하다는 사실은 알게 되었습니다. 그렇다면 실제 산업에서 연속 증류 과정은 어떻게 구현될까요? 실제 연속 증류 장치는 그림 4처럼 원통 모양의 증류 장치 여러 개가 위로 쌓인 형태를 갖습니다. 보통 각각의 증류기는 서로 다른 온도에서 작동하게 됩니다. 원하는 농도의 용액을 만들어내기 위해서는 몇 개의 증류기를 각각 어떤 온도에서 작동시킬 것인지가 관건입니다.
3 지표면에서 공기의 압력, 표준대기압 1atm
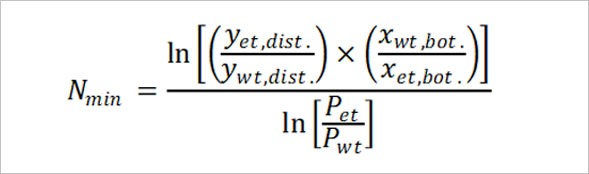
Fenske equation을 원소주 생산에 적용해볼까요? 원소주의 도수는 22도로, 이는 전체 혼합물 중 에탄올의 부피가 0.22만큼 들어있다는 뜻입니다. 즉 원소주 한 병의 용량 375mL 중 에탄올은 82.5mL, 물은 292.5mL만큼 혼합되어 있는 것이지요. 두 물질의 부피에 에탄올의 밀도 0.789g/mL와 물의 밀도 0.997g/mL를 곱하면 한 병에 들어있는 에탄올과 물의 질량 65.1g, 292g을 각각 구해낼 수 있습니다. 한편 물의 분자 질량이 18.01g/mol정도이고, 에탄올의 분자 질량이 46.07g/mol이므로, 원소주 속 에탄올과 물의 몰분율은 다음과 같이 계산됩니다.
4 어떤 물질이 특정 온도, 압력에서 머금을 수 있는 최대 증기압
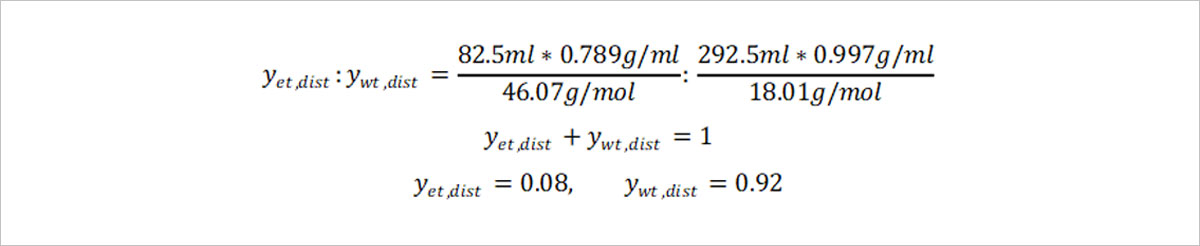
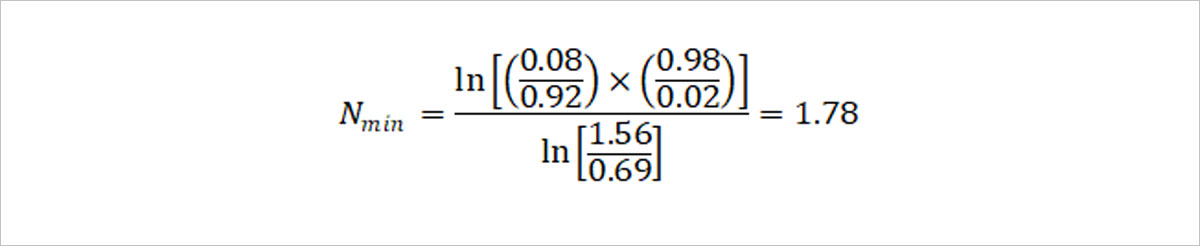
증류기는 화학공학에서 사용되는 장치들 중 분리기(separator)의 일종입니다. 실제 산업에서 어떠한 반응물로부터 원하는 생생물을 만들어 내기 위해서는 수많은 반응기와 분리기들이 서로 복잡하게 연결되어야 하지요. 화학공학자들은 이러한 장치들이 안전하고 효율적이게 작동할 수 있도록 화학 반응 공정을 설계하는 역할을 합니다. 우리 주변 다양한 음식 제품 속에도 이러한 빼놓을 수 없는 공학적 원리가 숨어 있답니다.
고등학생 독자들에게 전하는 말
기사에서는 소주의 생산 공정과 관련된 여러 공학적 원리들을 다루었지만, 음주는 청소년기에 절대로 경험해서는 안 되는 일입니다. 모쪼록 기사의 공학적 가치가 잘 전달되었길 바라며, 호기심에서라도 청소년 유해 물질을 접하는 일이 없도록 당부드립니다.
- 서울대학교 공과대학 학생홍보 기자단 일동-
- 그림출처
-
그림 1. https://economist.co.kr/2022/02/19/industry/distribution/20220219170009525.html
그림 2,3 https://www.researchgate.net/figure/T-xy-diagrams-of-the-ethanol-water-system-Azeotropes-in-a-10atm-and-in-b-10atm_fig2_334523794
그림 4. https://pixabay.com/ko/photos/%eb%af%b8%ec%97%90%ed%98%84-%ec%84%9d%ec%9c%a0-%ea%b3%b5%ec%9e%a5-%ec%a0%9c%ec%a1%b0-1362785/


